Wie entstehen Wasserstoffbrücken
Wasserstoffatome bilden in bestimmten Molekülen Wasserstoffbrücken. Diese relativ schwachen Bindungen spielen eine herausragende Rolle in der Natur. Unter anderem begründen sie die speziellen Eigenschaften des Wassers, die Struktur von Proteinen und der DNA-Doppelhelix. Eigentliche sind Wasserstoffbrücken lediglich ganz besondere Dipol-Dipol-Wechselwirkungen.
Inhalt
Was ist ein Dipol?
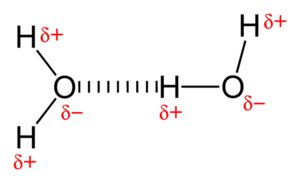
Ein Dipol ist ein Molekül mit einem positiven und einem negativen Pol (di heißt zwei). Ein Wassermolekül ist zum Beispiel ein Dipol.
Wie entsteht dieser Dipol im Wassermolekül?
Ein Molekül Wasser besteht aus einem Sauerstoffatom und zwei Wasserstoffatomen. Die Atome von Wasserstoff und Sauerstoff unterscheiden sich in ihrer Elektronegativität. Das elektronegativere Atom (Sauerstoff) zieht die Bindungselektronen deutlich stärker zu sich. Dadurch bekommt das Wassermolekül am Sauerstoff eine negative Teilladung, der Wasserstoff bekommt eine positive Teilladung. So entsteht ein Dipol.
Was ist die Elektronegativität?
Elektronegativität ist die Fähigkeit eines Atoms, Bindungselektronen anzuziehen. Wasser besteht – wie gesagt – aus zwei verschiedenen Atomsorten: Aus Wasserstoffatomen und Sauerstoffatomen. Wasserstoff hat eine Elektronegativität von 2,2. Sauerstoff hat eine Elektronegativität von 3,5. Sauerstoff ist also deutlich elektronegativer als Wasserstoff.
Die Elektronegativität findest du im Periodensystem. Bei jedem Element steht der Wert rechts oben.
Wie entstehen jetzt die Wasserstoffbrücken?
Der positive Pol des einen Wassermoleküls richtet sich zum negativen Pol des anderen Wassermoleküls aus. Die positive Teilladung an Wasserstoff des einen Wassermoleküls will zur negativen Teilladung des Sauerstoffs eines anderen Wassermoleküls. Diese Wechselwirkungen sind die Wasserstoffbrückenbindungen. Es sind Anziehungskräfte zwischen den einzelnen Molekülen.
Gibt es Wasserstoffbrücken nur im Wasser?
Nein. Wasserstoffbrücken entstehen, wenn Wasserstoff an ein deutlich eletronegativeres Atom gebunden ist. Fluor (Elektronegativität 4), Sauerstoff (Elektronegativität 3,5), Chlor(Elektronegativität 3,16) und Stickstoff (Elektronegativität 3). Die gängigsten Verbindungen mit Wasserstoffbrücken sind Flusssäure (HF) Wasser (H2O) Salzsäure (HCl) und Ammoniak (NH3).
Auch bei den anderen Verbindungen bilden sich Wasserstoffbrücken nach demselben Prinzip. Stark elektronegative Atome ziehen das bindende Elektronenpaar an, die Atombindung ist somit stark polarisiert. An den Wasserstoffatomen besteht ein Elektronenmangel und sie treten mit den freien Elektronenpaaren eines anderen elektronegativen Atoms in Wechselwirkung. Wasserstoffbrücken können sich zwischen gleichartigen aber auch zwischen unterschiedlichen Molekülen bilden.
Wie stark sind die Wasserstoffbrücken?
Diese zwischenmolekularen Kräfte sind relativ schwach, dennoch bestimmen sie maßgeblich die Eigenschaften von Stoffen. Unter den Dipol-Dipol-Wechselwirkungen sind Wasserstoffbrücken die stärksten. Sie sind stärker als Van-der-Waals-Kräfte, aber schwächer als kovalente Bindungen und Ionenbindungen.
Der Verbund über Wasserstoffbrücken besteht nur für Bruchteile von Sekunden. Dann lösen sich die einzelnen Moleküle wieder aus dem Verbund und verketten sich in einem nächsten kurzen Zeitraum erneut mit anderen Molekülen
Welche Auswirkungen haben Wasserstoffbrücken auf Stoffeigenschaften?
Die besonderen Eigenschaften von Wasser beruhen zum großen Teil auf den Wasserstoffbrücken.
- Die höhere Siedetemperatur von Wasser (100 Grad): Stoffe, die so klein und leicht wie Wasser sind, liegen bei 25° in Gasform vor. Doch die H-Brücken halten die Wassermoleküle zusammen. Zum Vergleich: Ein Molekül Wasser (H2O) und ein Molekül Schwefelwasserstoff (H2S) sehen sehr ähnlich aus. Der Siedepunkt von H2S liegt aber bei -60 Grad! Grund: Der Schwefelwasserstoff bildet keine Wasserstoffbrücken aus.
- Die starke Oberflächenspannung von Wasser: Kleine Objekte, wie Büroklammern schwimmen, obwohl Metall eigentlich im Wasser untergeht. Das nutzen z. B. Wasserläufer.
- Die Dichteanomalie des Wassers: Beim Gefrieren verbinden sich die Wassermoleküle zu einem regelmäßigen Molekülgitter mit großen Hohlräumen. Dadurch nimmt Eis ein größeres Volumen als flüssiges Wasser. Eis schwimmt auf dem Wasser
Über den Autor