Dichteanomalie des Wassers: Ursachen und Bedeutung
Die Dichteanomalie des Wassers besagt, dass Wasser sich – in Bezug auf seine Dichte – ganz anders verhält als andere Stoffe. Normalerweise steigt die Dichte eines Stoffes, wenn man ihn einfriert. In gefrorenem Zustand ist seine Dichte am höchsten. Nicht so bei Wasser. Eis ist leichter als flüssiges Wasser und schwimmt oben.
Warum hat Wasser so viele erstaunliche Eigenschaften?
Das liegt an seinem Aufbau und den speziellen Eigenschaften des Wassermoleküls.
Inhalt
Aufbau des Wassermoleküls als Ursache für die Dichteanomalie
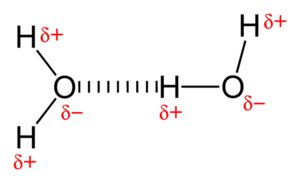
Wasser ist ein Dipol. Es besteht aus einem (stark elektronegativen) Sauerstoffatom und zwei Wasserstoffatomen. Der elektronegative Sauerstoff zieht das bindende Elektronenpaar (in Bezug zu den Wasserstoffatomen) an, deshalb ist die Atombindung polarisiert. An den Wasserstoffatomen herrscht ein Elektronenmangel und eine positive Teilladung. Am Sauerstoff herrscht eine negative Teilladung. Solche Moleküle (mit unterschiedlichen Polen) sind Dipole.
Durch Wasserstoffbrücken entsteht die Dichteanomalie
Wasserstoffbrücken sind Kräfte, die zwischen den Wassermolekülen entstehen. Negative Ladungen und positive Ladungen (auch Partialladungen wie im Wasser) ziehen sich gegenseitig an, Wasser besteht aus vielen Wassermolekülen und diese Moleküle richten sich aus: Der Pluspol (Wasserstoff) des einen Wassermoleküls und der Minuspol (Sauerstoff) des anderen Wassermoleküls ziehen sich an.
Schon haben wir eine Wasserstoffbrückenbindung zwischen den beiden Wassermolekülen. Diese Anziehungskräfte sind nicht sehr stabil, aber enorm wichtig.
Wasserstoffbrückenbindungen machen Wasser flüssig
Wasserstoffbrückenbindungen schützen Wasser davor, bei sehr niedrigen Temperaturen zu verdampfen. Wassermoleküle sind klein und leicht. Normalerweise liegen kleine, leichte Moleküle bei 25 Grad längst als Gas vor.
Wasser jedoch wird durch die Wasserstoffbrückenbindungen deutlich fester zusammengehalten als andere Moleküle. Bevor Wasser verdampft (in den gasförmigen Zustand übergeht) müssen diese Bindungen gebrochen werden. Das benötigt viel Energie, denn Wasser siedet erst bei hundert Grad Celsius.
Andererseits ist Wasser flüssig und nicht hart, weil die Wassermoleküle eben nur Teilladungen enthalten. Echte Ladungen (Ionen) sind sehr starke Kräfte. Salze z.B. werden durch Ionenbindungen zusammengehalten. Mit Ionenbindungen wäre Wasser fest und spröde, anstatt flüssig.
Das bedeutet….
Ohne Wasserstoffbrückenbindungen würde es bei uns auf der Erde kein Wasser geben.
Wasserstoffbrückenbindungen lassen Eis schwimmen
Eis schwimmt oben, weil es eine geringere Dichte hat als flüssiges Wasser.
Beim Gefrieren von Wasser passiert nämlich Folgendes: Die Wassermoleküle lagern sich zu einem Sechsring zusammen. Dieser wird – wie könnte es anders sein – durch Wasserstoffbrückenbindungen verbunden. In der Mitte des Sechsrings entsteht ein Freiraum. Diese Freiräume verursachen die geringere Dichte von Eis.
Diese Sechsecke sind der Grund warum wir im Winter so schöne symmetrische Eiskristalle sehen. Du findest in Schneeflocken überall die sechseckige Form wieder.
Was ist die Dichteanomalie des Wassers?
Wasser hat mit 4 Grad Celsius die höchste Dichte.
Warum?
Das liegt an der speziellen Struktur von Eis. Schmilzt Du das Eis, so beginnt das Gitter aus Sechsringen zuerst an einigen Stellen zu brechen. Das Eis zerfällt in überwiegend kleine, flächige Bruchstücke. Diese kleineren Stücke rücken näher zusammen. Sie brauchen weniger Platz als die Gitterstruktur im Eis. Das schmelzende Eiswasser hat eine größere Dichte als das Eis.
Bei 4 Grad Celsius hat Wasser seine höchste Dichte erreicht. Das ist die Dichte-Anomalie des Wassers. Erwärmst du das Wasser weiter, so zerfallen auch die flächigen Bruchstücke. Durch die Wärme steigt die Bewegung der Moleküle weiter an. Die Dichte des Wassers nimmt ab, das Wasser wird leichter.
Das heißt jetzt…
Da flüssiges Wasser eine größere Dichte als gefrorenes Eis hat, ist Wasser schwerer. Das Eis ist leichter und schwimmt deshalb oben. Am Grunde eines (tiefen) Gewässers ist das Wasser immer 4 Grad kalt. Denn bei dieser Temperatur hat Wasser seine höchste Dichte und ist somit am schwersten. Deshalb können z.B. Fische den Winter in einem zugefrorenen Gewässer überleben.
Wasser ist flüssig und aufgrund seiner Struktur ein perfektes Lösungsmittel. Für das Leben ist die wichtigste Aufgabe des Wassers wohl die Aufgabe als Transportmittel. Durch den Dipol ist es ein polares Lösungsmittel. Lebenswichtige Substanzen lösen sich in Wasser. Dadurch transportiert Wasser diese Substanzen in Pflanzen, Tieren und Menschen. Ohne Wasser kein Leben.
Über den Autor