Außenelektronen: 5 Fragen und Antworten
Als Außenelektronen bezeichnet man die Elektronen der äußersten Elektronenschale im Orbitalmodell. Bei den Atomen der Hauptgruppenelemente werden die Außenelektronen auch als Valenzelektronen bezeichnet.
Inhalt
Was sind Außenelektronen
Außenelektronen sind Elektronen, welche sich in der äußeren Schale einer Elektronenhülle befinden. Sie liegen demnach am weitesten vom Atomkern entfernt.
Wie lässt sich die Anzahl der Außenelektronen bestimmen
Das Schalenmodell beschreibt den Aufbau der Atomhülle anhand von Elektronenschalen. Diese Schalen werden mit Elektronen gefüllt. Die Füllung geschieht von innen (nahe Atomkern) nach außen. Dabei kann jede Elektronenschale nur eine bestimmte Menge an Elektronen aufnehmen.
Die innere Schale wird als K-Schale bezeichnet. Dann folgt die L-Schale, die M-Schale usw. Jede Schale hat eine gewisse Kapazität:
- K-Schale: 2 Elektronen
- L-Schale: 8 Elektronen
- M-Schale: 18 Elektronen
- N-Schale: 32 Elektronen
Für die ersten 20 Elemente des Periodensystems gilt zudem, dass die M-Schale nur 8 Außenelektronen fasst. Demnach bilden die Elemente mit den Ordnungszahlen 1 bis 20 eine Ausnahme.
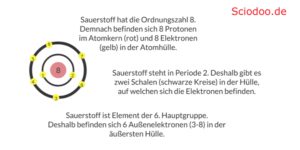
Wenn man nun bspw. für Sauerstoff die Außenelektronen bestimmen möchte, schaut man ins Periodensystem und erkennt, dass Sauerstoff die Ordnungszahl 8 hat. Demnach besitzt Sauerstoff 8 Protonen im Atomkern und 8 Elektronen in der Atomhülle. Die Besetzung der Elektronenschalen erfolgt dann von innen nach außen. Man beginnt mit der K-Schale:
- K-Schale: 2 Elektronen (vollständig gefüllt)
- L-Schale: restlichen 6 Elektronen (nur teilweise gefüllt)
Demnach besitzt Sauerstoff 6 Außenelektronen in der L-Schale.
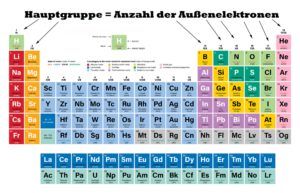
Wo kann man die Anzahl der Außenelektronen im Periodensystem ablesen
Die Anzahl der Außenelektronen kann für die ersten 20 Elemente über das Periodensystem bestimmt bzw. abgelesen werden. Dazu muss die Hauptgruppe des jeweiligen Elementes abgelesen werden.
Die Hauptgruppen-Einteilung entspricht den Spalten des Periodensystems. Sauerstoff steht bspw. in der 6 Hauptgruppe, weshalb der Sauerstoff auch 6 Außenelektronen hat.
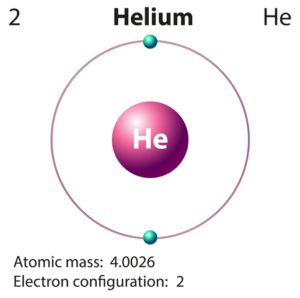
Warum hat Helium nur 2 Außenelektronen und nicht 8
Helium hat die Ordnungszahl 2, besitzt demnach 2 Protonen im Atomkern und 2 Elektronen in der Atomhülle.
Als Edelgas steht Helium in der 8 Hauptgruppe. Dort werden alle Edelgase aufgelistet. Dennoch kann Helium keine 8 Außenelektronen haben, da sich insgesamt nur 2 Elektronen in der Atomhülle befinden. Demnach befinden sich beide Elektronen des Heliums in der inneren K-Schale, welche dadurch voll besetzt ist.
Warum geben Metalle ihre Außenelektronen ab und Nichtmetalle nehmen Außenelektronen auf
Ob ein Element eine bestimmte Anzahl an Außenelektronen aufnimmt oder abgibt hat, etwas mit der äußeren Schalenbesetzung und deren Fassungsvermögen zu tun. Befinden sich bspw. 6 Außenelektronen in der äußeren Schale und die Kapazität der Elektronenschale entspricht 8 Elektronen, dann wird dieses Element 2 Elektronen aufnehmen – um die Schale voll zu bekommen. Es macht keinen Sinn – 6 abzugeben, wenn man einfach 2 aufnehmen kann.
Hat ein Element allerdings nur 2 Außenelektronen in der äußeren Schale, benötigt allerdings 8 Elektronen, um diese zu füllen – wird dieses Element nicht sechs Elektronen aufnehmen. Stattdessen wird es diese zwei abgegeben und somit die letzte Schale aufgeben. Hat es diese beiden Elektronen abgegeben, verfügt das Element über eine vollbesetzte innere Schale (innere Schale), welche dann zur Außenschale wird.
Über den Autor