So funktionieren Proteinabbau und Eiweißverdauung im Organismus
Proteine sind Biomakromoleküle (große Moleküle, die teilweise aus mehreren Untereinheiten bestehen), die sich in jeder Zelle eines Organismus befinden. Aufgrund der Häufigkeit ihres Vorkommens und ihrer Molekülmasse machen sie etwa 50% der Trockenmasse eines Lebewesens aus. Um den Verdau bzw. den Abbau von Proteinen nachvollziehen zu können, ist es unerlässlich, den Aufbau von Proteinen zu verstehen.
Inhalt
Das Verständnis vom Proteinaufbau ist die Grundlage für die Erklärung des Proteinabbaus
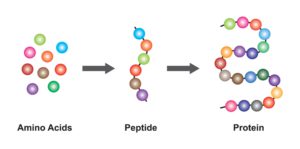
Der allgemeine Aufbau von Proteinen ist relativ einfach gehalten. Grundsätzlich bestehen sie aus einer Verkettung von verschiedenen Aminosäuren. Insgesamt gibt es 20 Aminosäuren, die an der Bildung von Proteinen beteiligt sind – sie werden auch proteinogene Aminosäuren genannt. Darüber hinaus gibt es viele andere Aminosäuren, die allerdings keine proteinbildenden Funktionen aufweisen. Die Verknüpfung der proteinogenen Aminosäuren geschieht über eine sogenannte Peptidbindung. Im weiteren Verlauf der Proteinbildung kommt es zur Ausbildung verschiedener dreidimensionaler Strukturen, die maßgeblich die Funktion des Proteins beeinflussen.
Aminosäuren (Amino acids) sind die Bausteine aller Proteine
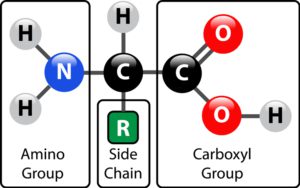
Aminosäuren stellen eine Gruppe chemischer Verbindungen dar, die sowohl eine Aminogruppe und eine Carbonsäuregruppe enthalten. Die Aminogruppe besteht aus einem Stickstoff-Atom (N) und zwei Wasserstoff-Atomen (H). Die Carbonsäuregruppe besteht aus einem Kohlenstoff-Atom (C), zwei Sauerstoffatomen (O) und aus einem Wasserstoff-Atom (H), das an das Sauerstoff-Atom gebunden ist, das eine Einfachbindung zum Kohlenstoff-Atom aufweist. Diese beiden Gruppen stellen die funktionellen Gruppen von Aminosäuren dar.
Die proteinogenen Aminosäuren unterscheiden sich dahingehend, dass lediglich ein anderer Rest an diese beiden funktionellen Gruppen angehängt wird. Die einfachste proteinogene Aminosäure ist das Glycin, das lediglich aus diesen beiden funktionellen Gruppen besteht und keinen angehängten Rest besitzt.
Weiterhin lassen sich die proteinogenen Aminosäuren in vier verschiedene Gruppen einteilen. Diese sind:
- unpolare/hydrophobe Aminosäuren: Hierzu zählen Alanin, Valin, Methionin, Leucin, Isoleucin, Prolin, Tryptophan, Phenylalanin.
- polare/neutrale Aminosäuren: Hierzu zählen Tyrosin, Threonin, Glutamin, Glycin, Serin, Cystein, Asparagin.
- basische Aminosäuren: Hierzu zählen Lysin, Arginin, Histidin.
- saure Aminosäuren: Hierzu zählen Glutaminsäure und Asparaginsäure.
Die jeweiligen Eigenschaften der einzelnen Aminosäuren beeinflussen zum Teil die durch die Peptidbindung entstehenden, dreidimensionalen Eigenschaften, die sich in verschiedenen Formen äußern.
Peptidbindung der Aminosäuren
Die Peptidbindung ist ein Bindungstyp, der die Verbindung zweier Aminosäuren beinhaltet. Zwei Aminosäuren werden miteinander verbunden, indem die Carboxygruppe (-COOH) der einen Aminosäure mit der Aminogruppe (NH2) der anderen Aminosäure reagiert. Der Reaktion wohnt eine Wasserabspaltung inne, weshalb sie auch als Kondensationsreaktion bezeichnet wird.
Diese Wasserabspaltung wird dadurch gewährleistet, dass die Hydroxygruppe (OH) der Carboxylgruppe (-COOH) mit einem Wasserstoffatom der Aminogruppe (NH2) reagiert. Somit entsteht als Reaktionsprodukt H2O (Wasser). Aufgrund der einzelnen Eigenschaften der Aminosäuren, die mittels Peptidbindung miteinander verknüpft werden, falten sich diese teils unterschiedlich, was zu verschiedenen Strukturen führt.
Primär-, Sekundär-, Tertiär-, Quartärstruktur
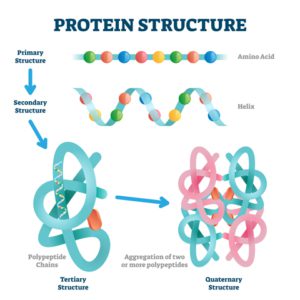
Die verschiedenen Strukturen, aus denen ein Protein besteht, lassen sich in vier Kategorien einteilen. Diese sind:
Primärstruktur
Die Primärstruktur beinhaltet lediglich die Aminosäuresequenz, aus der das Protein gebildet wird. Einen direkten Aufschluss über die dreidimensionalen Strukturen erhält man aus der Primärstruktur nicht ohne weiteres, obwohl in der Primärstruktur alle essenziellen Informationen enthalten sind. Um die dreidimensionale Struktur eines Proteins anhand der Primärstruktur ermitteln zu können, werden teilweise quantenmechanische Berechnungen, Kraftfelder und Datenbankvergleiche benötigt. Hierfür bietet sich beispielsweise die Software AlphaFold an.
Sekundärstruktur
Aufgrund der Vielfalt an Kombinationsmöglichkeiten, die aus den verschiedenen Aminosäuresequenzen hervorgehen, wäre es denkbar, dass es nahezu unendlich viele Strukturen gibt, die in Proteinen vorkommen. Dem ist jedoch nicht so, da sich häufig die gleichen Motive der Strukturen wiederholen. Der Grund hierfür könnte darin liegen, dass diese Strukturen energetisch stabil sind und somit im Laufe der Evolution eine weitere Verbreitung gefunden haben als andere Strukturen. Besonders häufig kommen hierbei zwei verschiedene Strukturen vor:
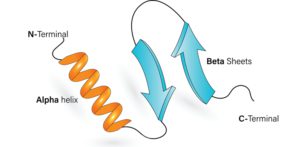
Alpha-Helix

Die Alpha-Helix ähnelt strukturell der DNS, da sie wie eine Wendeltreppe aufgebaut ist. Die lange Kette aus Aminosäuren windet sich umeinander, indem sogenannte Wasserstoffbrückenbindungen zwischen benachbarten Aminosäuren ausgebildet werden.
Beta-Faltblatt (beta-sheets)
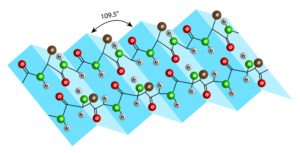
Das Beta-Faltblatt (sheet) stellt eine weitere wichtige Struktur innerhalb der Sekundärstrukturen dar. Es ähnelt einem geriffelten Blatt, ähnlich wie das Zwischenstück einer Ziehharmonika. Die Verknüpfung zweier Aminosäurenstränge erfolgt hierbei entweder parallel oder antiparallel.
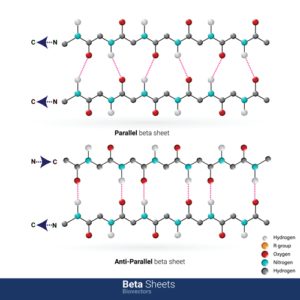
Bei der antiparallelen Verknüpfung werden jeweils die Carbonyl (CO)- und Aminogruppe des einen Stranges mit der Carbonyl- und Aminogruppe des anderen Stranges verknüpft. Dies geschieht wie bei der Alpha-Helix über Wasserstoffbrückenbindungen.
Die parallele Verknüpfung geschieht, indem die Aminogruppe des einen Stranges mit der Carbonylgruppe verbunden wird, während die Carbonylgruppe des einen Stranges mit der Aminogruppe des anderen Stranges verknüpft wird, die zwei Reste entfernt liegt.
Darüber hinaus existieren auch noch Mischformen aus der parallelen und antiparallelen Form.
Tertiärstruktur
Fassen wir kurz zusammen: Aus dem Zusammenschluss mehrerer Aminosäuren über Peptidbindungen bilden sich Proteine mit einer Primärstruktur. Schließen sich zwei Primärstrukturen zusammen, entstehen Sekundärstrukturen, deren Gebilde entweder einem Alpha-Helix oder einem Beta-sheet entspricht.
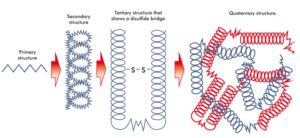
Werden alle Sekundärstrukturen eines Proteins zusammengefasst, wird dieses Gesamtbild als Tertiärstruktur bezeichnet. Im lebenden Organismus werden Proteine tatsächlich durch andere Proteine (z.B. Chaperone) in ihre aktive Form versetzt, indem die Chaperone die korrekte Faltung des jeweiligen Proteins vollführen.
Innerhalb der Tertiärstruktur bilden sich aber auch noch weitere Strukturen aus, die wiederum aus den einzelnen Sekundärstrukturen zusammengesetzt sind. Diese sind u.a. das Helix-Bündel, das auch verschiedenen Alpha-Helices besteht, oder das Beta-Fass, das eine Fass-ähnliche Struktur bildet, indem mehrere Beta-Faltblätter aneinandergelagert werden.
Innerhalb der Tertiärstruktur herrschen noch weitere Bindungstypen vor, die die dreidimensionale Struktur stabilisieren. Hierunter fallen die Disulfidbrücken (Verbindung zweier Schwefel–Atome), die Ionenbindungen (elektrostatische Bindung unterschiedlich geladener Ionen), ebenfalls Wasserstoffbrückenbindungen und die hydrophoben Wechselwirkungen.
Quartärstruktur
Besteht ein Protein aus mehreren Untereinheiten, so bildet sich eine sogenannte Quartärstruktur. Ein Beispiel für eine Quartärstruktur stellt das Hämoglobin dar. Hämoglobin besitzt vier gleiche Untereinheiten des Globins, in deren Mitte eine Häm-Gruppe eingebettet ist. Da es aus vier Untereinheiten besteht, wird es auch als Tetramer (Tetra = vier) bezeichnet.
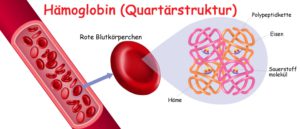
Die Stabilität der einzelnen Untereinheiten wird u.a. durch Wasserstoffbrückenbindungen, Van-der-Waals-Kräfte und Coulomb’sche Kräfte gewährleistet. Häufig existieren Quartärstrukturen bei Proteinen, die sich zu Komplexen zusammenlagern. Dies ist beispielsweise bei Faserproteinen wie Kollagen und Keratin der Fall. Auch globuläre/kugelförmige Proteine wie das oben erwähnte Hämoglobin, das Myoglobin oder auch die an der Proteinsynthese beteiligten Ribosomen weisen solche Quartärstrukturen auf.
Proteolyse ist der Abbau der Proteine
Aufgrund der oben genannten Eigenschaften ist die Komplexität und die damit einhergehenden Schwierigkeiten bei der Strukturbestimmung aus der Primärstruktur nachvollziehbar. Im Folgenden soll jedoch nicht der Aufbau von Proteinen erläutert werden, sondern der Abbau. Der Abbau von Proteinen wird auch als Proteolyse bezeichnet. Durchgeführt wird die Proteolyse von Enzymen, genauer von Peptidasen. Allerdings können sich Peptidasen teilweise selbst abbauen, weshalb man hierbei von Autoproteolyse spricht.
Eine Einteilung der Proteolyse erfolgt anhand des Ortes, an dem sie stattfindet. Sie kann entweder innerhalb der Zelle stattfinden, dann wird sie intrazelluläre Proteolyse genannt. Findet sie hingegen außerhalb der Zelle statt, dann bezeichnet man sie als extrazelluläre Proteolyse. Bei der intrazellulären Proteolyse kann weiterhin unterschieden werden, ob der Abbau zelleigener Proteine im sogenannten Proteasom stattfindet oder aufgenommene Proteine im Lysosom verdaut werden.
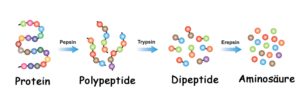
Die extrazelluläre Proteolyse kann entweder durch membranständige Proteasen erfolgen, die Proteine der extrazellulären Matrix verdauen, oder durch Proteasen, die im Gastrointestinaltrakt (Verdauungstrakt) synthetisiert werden. Typische Proteasen des Gastrointestinaltraktes sind z.B. Pepsin, Trypsin und Chymotrypsin etc.
Weiterhin können Peptidasen in Exo- und Endo-Peptidasen unterteilt werden. Exopeptidasen verdauen Proteine stets beginnend beim N- oder C-Terminus (N-Terminus an der Aminogruppe, C-Terminus an der Carboxylgruppe). Endopeptidasen verdauen Proteine anhand einer spezifischen Erkennunssequenz und werden anhand ihres aktiven Zentrums unterteilt.
Verschiedene Proteine verweilen unterschiedlich lang in Zellen des Organismus. Dabei spielen die Peptidasen aufgrund ihrer Fähigkeit zum Proteinverdau eine Essenzielle Rolle. Die während der Proteolyse abgespaltenen Aminosäuren stehen bei der Proteinbiosynthese wieder zur Verfügung, um daraus neue Proteine zu synthetisieren.
Proteolyse in Proteasomen
Als Bestandteil der Proteinqualitätskontrolle innerhalb von Zellen sind Proteasome am Proteinstoffwechsel beteiligt. Damit Proteine abgebaut werden können, müssen diese zunächst entfaltet und in das Proteasom eingeschleust werden. Sobald das Protein im Proteasom eingeschleust wurde, wird es von Untereinheiten des Proteasoms in kürzere Abschnitte, sog. Peptide, geschnitten.
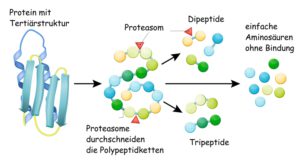
Proteasome sind für den Erhalt von Zellen lebensnotwendig. Einerseits werden Enzyme abgebaut und somit reguliert, andererseits werden auch Proteine, die den Zellzyklus regulieren, abgebaut. Aber auch Proteine, die aufgrund ihrer falschen Faltung Schäden an der Zelle ausüben könnten, werden vom Proteasom zerschnitten und somit unschädlich gemacht.
Weiterhin spielen Proteasome auch im Immunsystem eine entscheidende Rolle. Einige Peptide, die vom Proteasom gebildet wurden, werden an das endoplasmatische Retikulum weitergeleitet, von wo sie an den Haupthistokompatibilitätskomplex 1 (MHC1) gebunden werden. Hier werden sie dem Immunsystem präsentiert und können somit behilflich sein, Krankheitserreger o.ä. frühzeitig zu erkennen.
Ist die Proteinqualitätskontrolle durch Proteasome gestört, so können Krankheiten entstehen. Ein Beispiel für solch eine Erkrankung stellt die ALS (Amyotrophe Lateralsklerose) dar, bei der einige Proteine nicht korrekt abgebaut werden.
Proteolyse im Lysosom
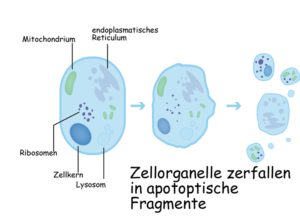
Lysosomen sind Organellen in eukaryotischen Zellen. Ihr Aufbau gleicht einem Vesikel, dessen Inneres einen sauren pH-Wert aufweist. Weiterhin enthalten sie verschiedene Verdauungsenzyme, die dazu beitragen, Biopolymere wie z.B. Proteine in kleinere Bestandteile, sog. Monomere, zu zersetzen. Lysosomen tragen dazu bei, zellfremdes und zelleigenes Material zu verdauen. Der Verdau von zelleigenem Material ist essenziell für den programmierten Zelltod, der auch Apoptose genannt wird.
Die Verdauung von zellfremdem Material geschieht im ersten Schritt durch Endozytose (Aufnahme von Stoffen über die Zellmembran). Hierbei verschmelzen zunächst Endosomen mit primären Lysosomen und bilden sekundäre Lysosomen. Ähnlich wie das Proteasom ist auch das Lysosom bei der Bildung des Immunsystems beteiligt. Hierbei werden Bruchstücke des zellfremden Materials, das durch das Lysosom gespalten wurde, an MHC-2-Rezeptoren weitergegeben und als Antigenfragmente präsentiert. Beim Proteasom wird diese Aufgabe von MHC-1-Rezeptoren ausgeführt.
Wird zelleigenes Material verdaut, spricht man von Autophagie (Selbstverdau). Somit können andere Zellorganellen oder Bestandteile des Cytosols mithilfe der Lysosomenenzyme verdaut werden und stehen für Aufbauprozesse wieder zur Verfügung. Dies hat den Vorteil, dass sich die Zelle stetig und selbstständig erneuert. Bei menschlichen Leberzellen führt dieser Prozess sogar so weit, dass ca. 50% der Zellbestandteile innerhalb einer Woche komplett erneuert werden.
Die Apoptose, die durch Lysosomen vorangetrieben wird, ist ein ebenso essenzieller Bestandteil des Zellstoffwechsels. Sie sorgt bspw. dafür, dass Kaulquappen ihre Schwänze, oder Menschen – während der Embryonalentwicklung – die Schwimmhäute zwischen den Fingern, verlieren.
Beispiele für Krankheiten, deren Ursprung in lysosomalen Fehlfunktionen liegt, sind die I-Zell-Krankheit, Morbus Hunter und die Wolman-Krankheit. All diese Krankheiten sind jedoch nicht in Verbindung mit dem Proteinstoffwechsel zu nennen.
Proteolyse im Gastrointestinaltrakt
Der Verdau von Proteinen im Gastrointestinaltrakt findet hauptsächlich im Magen und Zwölffingerdarm (Duodenum) statt und wird von der Bauchspeicheldrüse (Pankreas) vorangetrieben. Wichtige Enzyme, die zum Verdau von Proteinen beitragen sind: Pepsin, Carboxypeptidasen, Aminopeptidasen, Trypsin, Chymotrypsin, Elastase und Kollagenase.
Pepsin
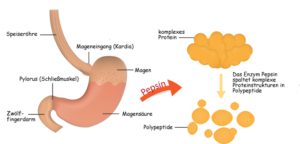
Pepsin zählt zu den Endopeptidasen und besteht aus 327 Aminosäuren. Ohne die Einwirkung der im Magen vorkommenden Salzsäure liegt Pepsin inaktiv als Pepsinogen vor. Als funktionelle Aminosäuren beinhaltet das Pepsin zwei Moleküle Asparaginsäure, die Proteine zu wasserlöslichen Peptonen umbaut. Die höchste Aktivität weist Pepsin bei einem pH-Wert zwischen 1,5 und 3 auf, ab einem pH-Wert von 7 wird es irreversibel denaturiert und kann somit keine Funktion mehr ausführen.
Carboxypeptidasen
Carboxypeptidasen zählen zu den Exopeptidasen, die Proteine vom C-Terminus aus spalten. Insbesondere an der Bildung von Carboxypeptidase A und B ist ein weiteres Enzym, das Trypsin, beteiligt. Sezerniert werden sie von der Bauchspeicheldrüse. Medizinische Verwendung findet insbesondere die Carboxypeptidase G2, die bei einer Vergiftung mit Methotrexat (Arzneimittel, das bei der Chemotherapie eingesetzt wird) als „Gegengift“ eingesetzt wird.
Aminopeptidasen
Die Abspaltung von Aminosäuren vom N-Terminus eines Proteins katalysieren Aminopeptidasen. Sie gehören zu den Exopeptidasen. Sie spielen insbesondere bei der Proteinverdauung im Darm eine essenzielle Rolle.
Trypsin
Trypsin zählt zu den Endopeptidasen und spaltet Proteine somit an gewissen Erkennungssequenzen. Es kommt vorwiegend im Dünndarm vor. Weiterhin ist es an der Aktivierung von Carboxypeptidasen beteiligt. Sollte ein Mangel an Trypin-1 vorliegen, können Proteine nur unzureichend vom Körper aufgenommen werden, was zu einer Form der Unterernährung führen kann. Eine mögliche Ursache für solch eine Krankheit ist die Mutation am TRY1-Gen. Ebenso kann durch solch eine Mutation eine Entzündung der Bauchspeicheldrüse entstehen, da durch nicht abgebautes Trypsin die Bauchspeicheldrüse verdaut wird.
Chymotrypsin
Chymotrypsin ist dem Trypsin strukturell sehr ähnlich und wird im Pankreas gebildet. Es liegt zunächst inaktiv als Chymotrypsinogen vor. Ähnlich wie das Trypsin muss es zuerst aktiviert werden. Dies geschieht jedoch nicht im Magen, sondern im Dünndarm. An der Aktivierung ist Trypsin ebenfalls beteiligt. Bevorzugt werden von Chymotrypsin aromatische Aminosäuren abgespalten.
Elastase
Ähnlich wie Chymotrypsin wird auch das Enzym Elastase in der Bauchspeicheldrüse gebildet. Es zählt zu den Endopeptidasen. Der Wirkort sämtlicher Elastasen ist der Dünndarm. Die Aktivierung erfolgt auch hier durch das Enzym Trypsin.
Kollagenase
Zu den Kollagenasen gehören sämtliche Enzyme, die Proteine zwischen der Aminosäure Prolin und anderen Aminosäuren spalten. Somit sind diese Enzyme dazu befähigt, Kollagen abzubauen, was wiederum der namensgebende Faktor ist.
Fazit
Proteine sind äußerst komplexe Moleküle, die weitreichende Funktionen im lebenden Organismus erfüllen. Obwohl sie nur aus 20 Aminosäuren in unterschiedlichen Zusammensetzungen bestehen, ist ihre Strukturvorhersage denkbar kompliziert. Ohne die katalytischen Eigenschaften von Proteinen wären Zellen nicht dazu in der Lage, sich selbst zu regenerieren oder mit ausreichend Nährstoffen versorgt zu werden.
Ebenso in der Entwicklung von Organismen sind Proteine maßgeblich an der Apoptose beteiligt, was dazu führt, dass sie u.a. zu der Erscheinung verhelfen, die Organismen im Normalfall aufweisen. Weiterhin sind Proteine dazu in der Lage, andere Proteine zu verdauen, damit diese einerseits als Quelle für die erneute Proteinsynthese zur Verfügung stehen, andererseits dienen sie aber auch als Kontrollinstanz innerhalb von Zellen, um falsch gefaltete Proteine zu spalten, damit diese keine schädigende Wirkung auf die jeweilige Zelle ausüben können.
Über den Autor