Agonist und Antagonist in Muskeln, Medizin und Biochemie
Der Antagonist ist, innerhalb der Literaturwissenschaft, ein Gegenspieler des Helden (Protagonisten). Somit ist der Antagonist ein Feind, Schurke oder Ähnliches. Im Körper – insbesondere im Muskel und Nervensystem – findet ebenfalls ein Gegenspielerprinzip statt. Hier stehen sich Antagonist und Agonist gegenüber. Deren Zusammenspiel ist in der Physiologie, Medizin, Psychologie, Sportwissenschaft und Biochemie von Bedeutung.
Inhalt
- 1 Allgemeine Unterschiede zwischen Antagonist und Agonist in verschiedenen Wissenschaften
- 2 Unterschied zwischen Agonist und Antagonist bei der Ligand-Rezeptor-Wechselwirkung
- 3 Rezeptortypen und deren Agonisten bzw. Antagonisten
- 4 Agonisten und Antagonisten im Nervensystem
- 5 Agonisten und Antagonisten in Muskelzellen
- 6 Alltägliche Beispiele von Agonisten und Antagonisten
- 7 Fazit
Allgemeine Unterschiede zwischen Antagonist und Agonist in verschiedenen Wissenschaften
Antagonist bedeutet Gegenspieler oder Widersacher. Demnach sind Antagonisten in der Literatur auch Gegner der Hauptfiguren, des Helden bzw. Protagonisten.
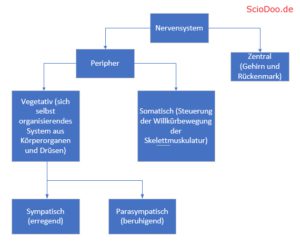
Innerhalb der Psychologie und Neurowissenschaften sind Antagonisten eine Komponente in einem bestimmten Wirksystem, innerhalb des Organismus. Die Gruppe der Antagonisten wirken dementsprechend hemmend, indem sie die Ausschüttung von Hormonen oder Neurotransmittern stoppen, verlangsamen oder verhindern.
Ihre Gegenspieler, die Agonisten, wirken dementsprechend förderlich und entfachen ihre Wirkung, in dem sie den Organismus bzw. einzelne Organe entsprechend erregen. Der Parasympathikus, als hemmender Teil des vegetativen Nervensystems und als Gegenspieler des Sympathikus, ist demnach ein Antagonist.
Bei Muskeln spricht man von Antagonisten als Gegenspieler der agonistischen Muskeln. So gibt es beispielsweise Beuger (flexors) und Strecker (extensors). Bei einer normalen Armbewegung dient der Bizeps als Beugemuskel und der entgegengesetzte Trizeps als Strecker.
Der Beuger (Bizeps, Agonist) wird bei einer Bewegung verkürzt, wodurch Spannung (Energie) in diesen Muskel aufgebaut wird. Gleichzeitig sorgt der Strecker, als Antagonist, für eine Gegenspannung – indem er sich auseinanderzieht. Dadurch findet eine Art von Tauziehen zwischen Bizeps und Trizeps statt, wodurch der Arm, als Ganzes, stabil bleibt. Somit wirkt der Antagonist ebenfalls als Gegenspieler des agonistischen Muskels und hemmt dessen kompletten Spannungsaufbau.
Allgemein wird der Trizeps lediglich als Antagonist des Bizeps gesehen. Dabei wird aber außer Acht gelassen, dass sich der Bizeps nicht allein strecken kann. Erst durch den agonistischen Spannungsaufbau im Trizeps wird der Bizeps über Sehne und Knochen zurückgezogen.
In der Pharmakologie stellt man antagonistische Arzneimittel her, welche bestimmte Organe und Bereiche im Individuum beruhigen sollen. Diese funktionieren analog den körpereigenen Antagonisten und sollen eine ungewollte Neurotransmitter– oder Hormonausschüttung stoppen bzw. verhindern. Außerdem gibt es auch agonistische Arzneimittel oder Drogen, welche in gewissen Bereichen auch Nebenwirkungen haben und durch den gezielten Einsatz antagonistischer Wirkstoffe partiell wirkungslos werden.
Unterschied zwischen Agonist und Antagonist bei der Ligand-Rezeptor-Wechselwirkung
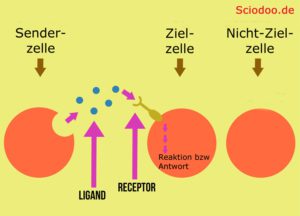
Agonisten und Antagonisten stellen ein Gegensatzpaar der Ligand–Rezeptor-Wechselwirkung dar.
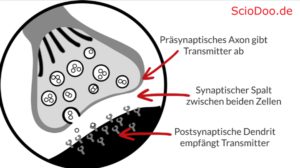
Ein Rezeptor nimmt chemische Botenstoffe, welche als Neurotransmitter bezeichnet werden, entgegen. Aufgrund ihrer speziellen Struktur kann der Rezeptor einer Zielzelle den chemischen Stoff erkennen und die Botschaft, welche das Nervensystem sendet – dadurch interpretieren. Vereinfacht gesagt, kann durch den Rezeptor die Botschaft in der Zielzelle umgesetzt werden, wodurch eben Hormone oder Enzyme ausgeschüttet werden. Das Gehirn als Entscheidungsorgan im Zentralnervensystem und allgemein im Organismus kann so mit allen Zielzellen des Körpers kommunizieren.
Die Ausschüttung der Neurotransmitter erfolgt über einen sogenannten synaptischen Spalt. Dabei werden die Neurotransmitter (chemischen Stoffe) über ein Ende einer Nervenzelle (präsynaptisches Axon) in den Spalt geschüttet. Die nächste Nervenzelle besitzt jene Rezeptoren und nimmt die Botenstoffe über das postsynaptische Dendrit auf. Eine Synapse besteht demnach auch einem Axon (Ende einer Nervenzelle), einem Spalt und einem Dendrit (Ende der benachbarten Nervenzelle). Die Erkennung der Botschaften erfolgt nach einem Schlüssel-Schloss-Prinzip.
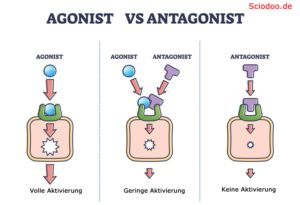
Agonisten sind Moleküle, die als Ligand (bindendes Molekül) an einem spezifischen Rezeptor binden. Die Bindung des Agonisten sorgt hierbei für eine Konformationsänderung (strukturelle Änderung inkl. Funktionsänderung) des Rezeptors.
Anders ausgedrückt….
Ein Ligand, welcher einen Rezeptor aktiviert – wird als Agonist bezeichnet. Falls ein Ligand einen Rezeptor hemmt oder deaktiviert, bezeichnet man diesen als Antagonist. Inverse Antagonisten gibt es ebenfalls. Diese Liganden kehren die Wirkung des Rezeptors um.
Jeder Rezeptor hat jedoch einen spezifischen, ursprünglichen Liganden, der die „natürliche“ Funktion erfüllt. Die Agonisten dieses Liganden imitieren ihn aufgrund ihrer chemischen Struktur.
Die Ligand-Rezeptor-Wechselwirkung wird in den meisten Fällen durch Enzyme beeinflusst, indem durch enzymatische Spaltung die Bindung von Ligand und Rezeptor getrennt wird. Bei Agonisten funktioniert diese Trennung lediglich eingeschränkt, was zu einer länger anhaltenden Konformationsänderung des Rezeptors und einer damit einhergehenden, veränderten Wirkung auf den Organismus führt.
Antagonisten sind, wie Agonisten auch, chemisch ähnliche Moleküle, die an einem spezifischen Rezeptor binden. Allerdings weisen diese eine zu große Unähnlichkeit an gewissen Stellen des Moleküls auf, sodass sie zwar an dem Rezeptor binden können, aber keine Konformationsänderung dessen bewirken. Dies führt zu einer Blockade des Rezeptors, was zur Folge hat, dass, im Falle des Nervensystems, Reize nur kaum oder nicht mehr weitergeleitet werden.
Oberflächlich betrachtet können Agonisten eher als „aktivierend“ bezeichnet werden, während Antagonisten eher eine „hemmende“ Wirkung aufweisen.
Um die Wirkung von Agonisten und Antagonisten besser verstehen zu können, ist es hilfreich, die zugrundeliegenden Mechanismen zunächst anhand der natürlichen Liganden zu verstehen, damit die Veränderung der Wirkung offensichtlich wird.
Rezeptortypen und deren Agonisten bzw. Antagonisten
Die Vielfalt an Rezeptortypen sowohl im tierischen als auch im pflanzlichen Organismus ist äußerst groß, sodass hier nur grundlegende Rezeptortypen erläutert werden.
Grundlegend können die folgenden Rezeptortypen an zwei Orten innerhalb von Zellen vorliegen, welche ich nun vorstellen möchte.
Cytoplasmatische Rezeptoren
Cytoplasmatische Rezeptoren liegen im flüssigen Raum der Zelle, dem Cytoplasma, vor. Der Grund hierfür ist, dass kleine oder unpolare Moleküle gut durch die Zellmembran hindurch diffundieren und somit den Zielrezeptor erreichen können.
Ein Beispiel für ein Molekül, das an einem cytoplasmatischen Rezeptor bindet, ist das Östrogen. Östrogen ist fettlöslich und passiert nahezu ungehindert die Zellmembran. Innerhalb der Zielzellen kann es somit an die passenden Rezeptoren binden.
Membranrezeptoren
Membranrezeptoren sind in der Zellmembran verankert, da ihre Liganden nur besonders schwer die Zellmembran überwinden können. Meist sind das große, polare Moleküle. Hierfür sind membranständige Rezeptoren mit einer extrazellulären Bindungsdomäne (Bindungsstelle, die außerhalb der Zelle liegt) die effizientere Möglichkeit, eine Ligand-Rezeptor-Wechselwirkung auszulösen.
Ein Beispiel für die Aktivierung von Membranrezeptoren stellt Insulin dar. Insulin ist ein Proteohormon (Protein mit der Wirkung eines Hormons), das nicht ohne weiteres die Zellmembran passieren kann.
Die Lokalisation der jeweiligen Rezeptoren beinhaltet allerdings nicht direkt die Wirkung einer Ligand-Rezeptor-Wechselwirkung. Diese hängt darüber hinaus von dem jeweiligen Rezeptortyp ab. Im Folgenden werden vier Rezeptortypen inklusive deren Agonisten und Antagonisten beschrieben.
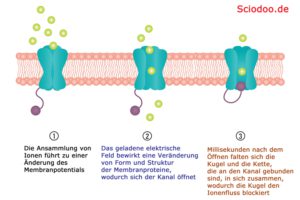
Ionenkanäle
Das Bild zeigt die Funktionsweise eines Ionenkanals ohne Einwirken eines Agonisten. Doch diese Funktion kann durch einen Agonisten gesteuert oder durch einen Antagonisten gehemmt werden.
Ionenkanäle sind membranständig. Weiterhin können diese ligandengesteuert sein. Wenn ein Ligand an solch einem Ionenkanal bindet, verändert sich dessen Konformation (Struktur), wodurch eine Öffnung oder ein Schließen des Kanals erfolgt.
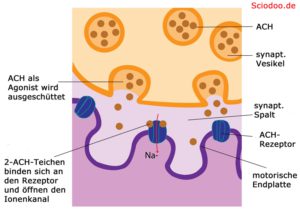
Der Acetylcholinrezeptor ist ein Beispiel für solch einen gesteuerten Ionenkanal. Er kommt bei Vertebraten (Wirbeltieren) in Plasmamembranen von Skelettmuskelzellen vor. Der natürliche Ligand dieses Rezeptors ist das Acetylcholin.
Binden zwei Moleküle Acetylcholin an solch einem Rezeptor, so kann er für etwa eine tausendstel Sekunde geöffnet werden. Daraufhin strömen Natrium–Ionen in die Zelle hinein, da einerseits die Konzentration von Natrium im extrazellulären Raum höher ist, aber auch die Ladung im äußeren deutlich positiver ist. Bei Muskelzellen wird durch den Einstrom von Natrium-Ionen ein Aktionspotenzial ausgelöst, was zu einer Kontraktion der Muskelzelle führt.
Durch das Ungleichgewicht zwischen Ladung im Außen und im Inneren der Zelle, strömen negativ geladene Natrium-Ionen (Na-)in die Zelle ein, nachdem der Antagonist (Acetylcholin) den Ionenkanal geöffnet hat. Diese lösen ein Nervenimpuls aus, da ein bioelektrisches Spannungsgefälle vorliegt. Durch den Nervenimpuls wird die Übermenge an negative Ladung im Muskel wieder ausgeglichen.
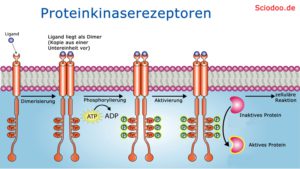
Proteinkinaserezeptoren
Einige Rezeptorproteine können zu Proteinkinasen werden, sobald sie aktiviert werden. Solche Kinasen sind Enzyme, welche einen Phosphatrest auf andere Substrate übertragen können. Sehr häufig geht es beim Phosphorylieren darum, den Phosphatrest des universellen Energieträgers ATP zu transferieren, indem entweder aus ATP ein ADP oder aus ADP wieder ATP wird.
Jedes Mal, wenn eine Phosphatgruppe des Energieträger ATP abgespalten wird, wird Energie freigesetzt – welchen die Zelle, das Organ bzw. der Organismus in Lebensaktivitäten (Fortpflanzung, Bewegung, Wachstum, Entwicklung usw.) investieren kann. Wird dem ADP wieder eine Phosphatgruppe angehangen, entsteht wieder ATP.
Diese ATP-Synthase findet beim Stoffwechsel statt, indem aus Glucose oder anderem Zucker, unter Zufuhr von Sauerstoff, dieser Energieträger aufgebaut wird.
Durch die Kinase-Aktivität sind Proteinkinasen dazu in der Lage, sich selbst, aber auch andere Proteine zu phosphorylieren (eine Phosphorylgruppe anzuhängen). Die Phosphorylierung führt wiederum zu einer Konformationsänderung, die in einer Funktionsänderung des jeweiligen Proteins mündet.
Ein Beispiel hierfür ist der bei Säugetieren vorkommende Insulin-Rezeptor. Insulin ist, wie bereits erwähnt, ein Proteohormon. Die Produktion des Insulins findet in der Bauchspeicheldrüse statt. Der Rezeptor ist membranständig und besteht aus zwei Kopien von zwei verschiedenen Untereinheiten. Somit kann man ihn auch als Homodimer eines Heterodimers bezeichnen.
Nach Aktivierung des Insulinrezeptors wird dieser phosphoryliert. Diese Phosphorylierung des Rezeptors endet in einer Phosphorylierung verschiedener Proteine innerhalb der Zelle, die beispielsweise Glucoserezeptoren in die Plasmamembran einlagern, um den aufgenommenen Zucker optimal zu verdauen.
G-Protein-gekoppelte Rezeptoren
G-Protein-gekoppelte Rezeptoren werden auch als 7-TM-Rezeptoren bezeichnet. Hierbei steht das 7-TM für die sieben Transmembrandomänen, aus denen diese Rezeptoren bestehen. Diese bestehen aus alpha-Helices, die die Zellmembran durchziehen. Somit sind diese Rezeptoren auch membranständig.
Die Bindung eines Liganden an solch einen Rezeptor bewirkt eine Veränderung der zellinneren Region des Rezeptors, wodurch ein mobiles Membranprotein (G-Protein) binden kann. Die meisten G-Proteine besitzen drei Untereinheiten und können somit drei unterschiedliche Moleküle binden. Dazu zählen z.B. der 7-TM-Rezeptor selbst, aber auch GDP/GTP (Guanosindiphosphat/ Guanosintriphosphat) oder andere Effektorproteine.
Bei der Bindung eines G-Proteins an ein aktiviertes Rezeptorprotein wird GDP durch GTP ersetzt. In diesem Moment wird in der Regel auch der Ligand wieder freigesetzt. Durch die Bindung des GTP wird eine Konformationsänderung des G-Proteins bewirkt. Die Untereinheit, an die das GTP gebunden ist, diffundiert daraufhin an der Plasmamembran entlang, bis es an ein Effektorprotein binden kann.
Die Effektorproteine können vielfältige Funktionen erfüllen, sie können enzymatische Reaktionen einleiten oder auch Ionenkanäle steuern. Nach der Aktivierung eines Effektorproteins wird das GTP des G-Proteins zu GDP hydrolysiert und somit die Inaktivierung des G-Proteins erreicht. Nach der Inaktivierung löst sich die G-Protein-Untereinheit und wandert so lange an der Zellmembran entlang, bis es wieder auf die zwei anderen G-Protein-Untereinheiten trifft, um daran zu binden. Nach dem Austausch des GDP durch GTP kann der Prozess erneut stattfinden.
G-Protein-Komplexe können eine Vielzahl an Funktionen erfüllen. Sie können Effektorproteine aktivieren, aber auch hemmen. Eine Aktivierung erfolgt beim Menschen beispielsweise am Rezeptor für Adrenalin. Adrenalin ist ein Hormon, das aufgrund von Stress- oder Fluchtsituationen in den Nebennieren produziert wird.
Im Herzmuskel bindet Adrenalin an einen G-Protein-gekoppelten Rezeptor und sorgt für die Aktivierung eines G-Proteins. Die GTP beinhaltende Untereinheit aktiviert daraufhin ein Enzym, das cAMP (zyklisches Adenosinmonophosphat) herstellt. Das cAMP hat in der Zelle viele verschiedene Aufgaben, eine davon ist die Bereitstellung von Glucose als Energiequelle der Herzmuskelkontraktion.
Gleichzeitig kann Adrenalin jedoch auch eine hemmende Wirkung besitzen. Bei der Verbindung von Adrenalin an einem Rezeptor, der sich in den Blutgefäßen der glatten Muskulatur des Verdauungstraktes befindet, wird ein Enzym gehemmt, wodurch die Blutgefäße erweitert werden. Hierdurch können Nährstoffe aus dem Verdauungstrakt schneller abtransportiert werden, um den Körper in Stresssituationen besser zu versorgen.
Das Adrenalin ist somit ein Beispiel dafür, dass der selbe Ligand in unterschiedlichen Zielgeweben mit unterschiedlichen Rezeptoren auch eine unterschiedliche Wirkung hervorruft.
Chemische Rezeptoren im Cytoplasma
Chemische Rezeptoren sind cytoplasmatische Rezeptoren, die Signalmoleküle binden. Durch die Konformationsänderung nach der Bindung eines Signalmoleküls kann der Rezeptor in den Zellkern gelangen, um dort gewisse Gene zu exprimieren (hervorzurufen). Anhand des Beispiels des Cortisons lässt sich dieser Prozess gut beschreiben, da dieser meistens deutlich komplexer ausfällt, als es die obige Beschreibung vermuten lässt.
Der Rezeptor, an den das Cortison bindet, liegt in seiner nativen (ursprünglichen) Form an ein Chaperonprotein gebunden vor. Durch das Chaperonprotein wird der Eintritt in den Zellkern verhindert. Bindet jedoch das Cortison an den Rezeptor, so wird das Chaperon abgelöst, das daraufhin den Rezeptor in eine für den Zellkern zugängliche Form verändert. Gelangt der Rezeptor daraufhin in den Zellkern, kann er dort gewisse Transkriptionsprozesse der DNA induzieren.
Agonisten und Antagonisten im Nervensystem
Anhand des Acetylcholinrezeptors lässt sich die Wirkung verschiedener Agonisten und Antagonisten auf das Nervensystem gut beschreiben. Ein häufig in der Augenheilkunde verwendeter Arzneistoff ist das Carbachol. Carbachol ähnelt dem Acetylcholin strukturell sehr, weshalb es als Agonist am muskarinischen Acetylcholinrezeptor binden kann.
Die agonistische Wirkung beeinflusst den Parasympathikus (Teil des Nervensystems, der für unwillkürliche Steuerung von Körperfunktionen zuständig ist). Wird Carbachol bei Glaukom-Patienten (grüner Star) verabreicht, so wird beispielsweise der Augeninnendruck gesenkt. Bei einer Katarakt-Operation bewirkt es auch die Verengung der Pupille.
Die verstärkte Wirkung erhält Carbachol durch die strukturelle Änderung der Acetylgruppe in eine Carbamoylgruppe. Somit verbleibt Carbachol länger am Rezeptor, als es das Acetylcholin tun würde. Dies liegt daran, dass die Acetylcholinesterase (das Enzym, das Acetylcholin abbaut) Carbachol nicht so effizient abbauen kann, wie das Acetylcholin.
Ein weiterer Agonist, der am Acetylcholinrezeptor bindet, ist das Arecolin. Arecolin ist ein pflanzliches Alkaloid aus der Betelnuss bzw. dem Betelpfeffer. Bei vermehrter oraler Aufnahme von Arecolin stellt sich eine euphorisierende Wirkung ein. Darüber hinaus wird auch der Speichelfluss verstärkt.
Durch die Daueraktivierung der Acetylcholinrezeptoren kann es zu Vergiftungserscheinungen kommen. Diese äußern sich durch eine erhöhte Erregung des Nervensystems, Erbrechen oder Krämpfen. Im Falle eines Herzkrampfes kann das sogenannte parasympathomimetische Syndrom auch tödlich enden.
Eine antagonistische Wirkung auf den muskarinischen Acetylcholinrezeptor bewirkt Atropin. Atropin ist ein Alkaloid, das in der schwarzen Tollkirsche enthalten ist. Durch die Blockade des Rezeptors ohne eine verstärkte Wirkung wird die Weiterleitung von Aktionspotenzialen unterbunden.
Bei der Anwendung in der Augenheilkunde wird Atropin verabreicht, um die Pupillen stark zu erweitern. Ein Übergang der lokalen Wirkung auf eine systemische Wirkung (Wirkung, die den gesamten Organismus betrifft) ist hierbei jedoch nahezu unmöglich, da Atropin nur sehr schwer außerhalb des Zielgewebes aufgenommen wird.
Agonisten und Antagonisten in Muskelzellen
Eine bekannte antagonistische Wirkung in Muskelzellen bewirkt das Botulinumtoxin, das unter dem Namen Botox bekannt ist. Es blockiert die Freisetzung von Acetylcholin, was zu einer Lähmung der betroffenen Muskulatur führt.
Ein Antagonist, der den Acetylcholinrezeptor blockiert, ist das Schlangengift alpha-Bungarotoxin. Die alpha-Form des Toxins blockiert die postsynaptischen Acetylcholinrezeptoren der motorischen Endplatte, was zu einer Lähmung führt. Die beta-Form greift hingegen an der präsynaptischen Membran an und verhindert dort die Freisetzung von Acetylcholin, was auch eine Lähmung zur Folge hat.
Muskelrelaxierende, lähmende Wirkungen erzeugt auch Curare. Curare ist eine alkaloidhaltige Substanz aus verschiedenen Pflanzen. Diese wurde aufgrund ihrer Wirkung oft als Pfeilgift eingesetzt, da selbst bei einer nicht tödlichen Verwundung des gejagten Tieres durch die Wirkung des Giftes das Tier bewegungsunfähig gemacht wurde. Die Wirkung des Giftes entsteht durch die Blockierung nikotinischer Acetylcholinrezeptoren, woraufhin keine Aktionspotenziale weitergeleitet werden können.
Alltägliche Beispiele von Agonisten und Antagonisten
Viele Menschen kommen täglich mit unterschiedlichen Substanzen in Kontakt, die sowohl eine agonistische als auch eine antagonistische Wirkung auf das Nervensystem und das Muskelsystem besitzen. Viele davon kann man auch als Drogen ansehen.
Koffein
Koffein ist, wie die oben genannten pflanzlichen Beispiele, ein Alkaloid. Darüber hinaus ist es das weltweit am meisten konsumierte Alkaloid. Die Wirkung des Koffeins ist eine antagonistische. Sie beruht darauf, dass Nervenzellen im Normalzustand Energie verbrauchen und dabei Adenosin freisetzen.
Je höher die Aktivität der Zelle ist, desto höher ist auch die Freisetzung des Adenosins. Wird Adenosin gebunden, so vermittelt dies der Nervenzelle ein Signal, nicht mehr die gleiche Aktivität aufzuweisen. Koffein kann als Antagonist des Adenosins ebenfalls an diese Rezeptoren binden und somit die Ermüdungserscheinungen des Nervensystems verhindern.
Nikotin
Auch Nikotin ist ein Alkaloid. Es entsteht in Tabakpflanzen und anderen Nachtschattengewächsen. Im Gehirn wirkt Nikotin an nicotinischen Acetylcholinrezeptoren, indem es agonistisch an diesen bindet. Diese Rezeptoren befinden sich sowohl in sympathischen und parasympathischen Ganglien, im zentralen Nervensystem und den motorischen Endplatten. Deshalb ist die Wirkung des Nikotins sehr divers. Es aktiviert beispielsweise parasympathische Nerven, während es sympathische Nerven hemmt. Außerdem werden Adrenalin, Serotonin und Dopamin vermehrt ausgeschüttet. Es beschleunigt den Herzschlag und verengt die Blutgefäße.
Cocain
Cocain ist ebenfalls ein Alkaloid, das in der Coca-Pflanze enthalten ist. Es wirkt antagonistisch an der präsynaptischen Membran, wo es die Wiederaufnahme von Noradrenalin verhindert. Hierdurch verbleibt Noradrenalin länger im synaptischen Spalt, was eine stimulierende und gleichzeitig euphorisierende Wirkung erzeugt. Darüber hinaus wirkt es lokalanästhetisch und vasokonstriktorisch (Blutgefäß verengend), weshalb es in den 1950er Jahren von Zahnärzten als Betäubungsmittel im Mundraum eingesetzt wurde.
Fazit
Liganden inklusive ihrer Agonisten und Antagonisten erzeugen vielseitige Wirkungen. Durch agonistische Wirkungen werden Reize in der Regel über eine längere Zeit aufrechterhalten, wohingegen bei einer antagonistischen Wirkung eine Verhinderung der Reizweiterleitung stattfindet. Die Wirkungen können sowohl im Nervensystem stattfinden, aber auch an der motorischen Endplatte, wodurch muskuläre Aktivitäten beeinflusst werden. Die muskuläre Beeinflussung kann sich sowohl in einer Lähmung als auch in einem Krampf äußern.
Darüber hinaus existieren viele Substanzen, insbesondere pflanzliche Alkaloide, die von Menschen konsumiert werden. Die Wirkung dieser Alkaloide hängt davon ab, ob sie agonistisch oder antagonistisch abläuft. Eine agonistische Wirkung hat meist eine Steigerung der Euphorie zur Folge, während antagonistische Wirkungen meist eine Entspannung erzielen.
Auch viele Gifte, wie z.B. das Botulinumtoxin oder Curare haben diverse Wirkungen auf die muskulären Aktivitäten im Organismus.
Abschließend lässt sich sagen, dass sowohl agonistisch als auch antagonistisch wirkende Substanzen teilweise einen medizinischen Nutzen aufweisen, wie es z.B. beim Carbachol der Fall ist. Auch Atropin ist ein medizinisch hilfreiches Alkaloid. Dennoch ist es auch eine Frage des zu tragenden Risikos im Vergleich zum gewonnen Nutzen, ob man eine Veränderung des internen Stoffwechsels in Kauf nehmen möchte, um solch eine Änderung zu erfahren.
Über den Autor